Un diamante es para siempre
Lo curioso de los diamantes es que no son más que átomos de carbono, bien colocados, pero de carbono. No es ningún compuesto especial como pueda ser el rubí, que necesita óxido de aluminio y además estar mezclado con hierro y cromo, no, es simplemente carbono.Y lo que es más raro aún, el grafito también es carbono, las minas de los lápices están hecha de átomos de carbono, igual que los diamantes, pero entonces ¿por qué el grafito es negro y mancha y el diamante es cristalino y duro?
Para encontrar las diferencias hay que bajar a muy baja escala, hay que ver cómo están organizados los átomos de carbono para entender las diferencias. Vamos a seguir paso a paso como construiríamos un diamante si pudieramos manejar átomos como piezas de lego.
Lo primero es colocar 8 átomos en las esquinas de un cubo, tal que así:

Para los que no vean el cubo (sí sí, ahora es facil, pero ya vereis después) lo dibujamos:
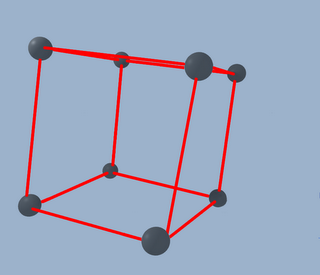
Bien, ya tenemos el principio. Esto sería una estructura "cúbica simple", pero no es suficiente, ahora necesitamos poner un átomo en cada cara del cubo, tal y como sigue:
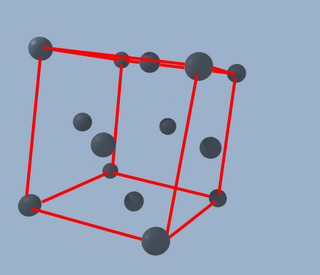
De manera que forman una especie de cruz que se cruza con centro en el centro del cubo (valga la redundancia)
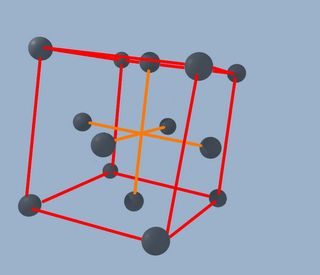
Con lo que ahora tenemos 14 átomos colocados así:

Pero todavía no hemos acabado. Ahora tenemos una red que se llama "fcc", (face centered cubic o cúbica centrada en las caras, en castellano). Lo interesante ahora es que por cada átomo de carbono, tenemos que colocar otro cerca de él ¿cómo de cerca? pues un cuarto del lado del cubo hacia la derecha, un cuarto hacia arriba y un cuarto hacia atrás, como se muestra en la imagen (sí, ya se que no está muy lograda pero es lo que hay):
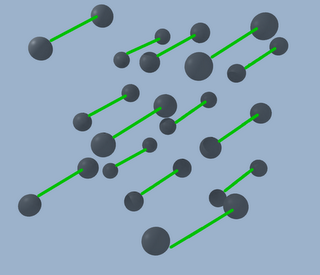
Donde se puede ver que seguimos teniendo el cubo original
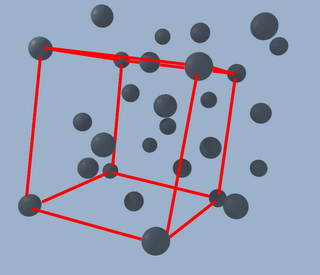
Pero también uno nuevo, con sus átomos en sus caras formando una cruz, resultado de duplicar el primero
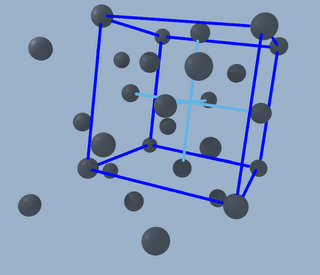
Así que finalmente tenemos
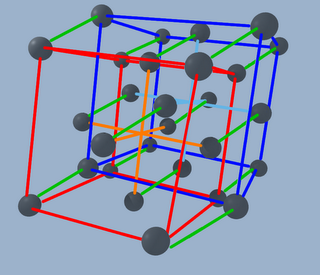
o quitando las lineas (y perdiendo de vista toda la estructura)

Todo esto está muy bien, pero... ¿por qué convierte al diamante en algo tan especial? Bueno, pues para eso hay que recordar un par de cosas de los tiempos de instituto. La valencia del carbono es 4, lo que significa que tiene 4 electrones libres en su capa de valencia y que o bien los cede, o bien gana otros 4 para tener su última capa completa. En la práctica lo que hace el carbono es compartir sus 4 electrones con otro átomo, de manera que entre los dos suman 8 y en una especie de simbiosis de "ahora los tiene uno, ahora los tiene otro", los dos tienen completa su capa de valencia. Pero tampoco es así porque no comparte los cuatro electrones con el mismo átomo, sino que hace 4 enlaces con otros 4 átomos diferentes. Y además, la manera más eficiente de hacer eso es que los electrones que se comparten estén lo más lejos posible los unos de otros, es decir, que si uno se va para la derecha, el otro para la izquierda. ¿Cómo se consigue esto con 4 electrones? Pues con un tetraedro, ya que estamos en un espacio de 3 dimensiones, usamos la figura en la que sus cuatro vertices están a igual distancia unos de otros
Pues bien, fijaos en la siguiente figura:
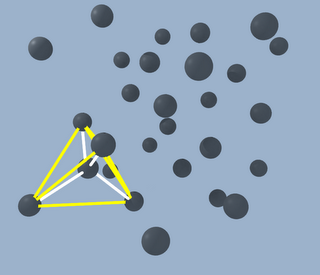
Las lineas blancas representan los enlaces de un átomo de carbono central con otros cuatro, mientras que las amarillas dibujan el tretaedro. Y lo mismo que pasa para ese ejemplo sucede para todos los átomos del diamante, así que resulta que el diamante es la estructura óptima del carbono, aprovechando al máximo la energía de los enlaces, y por eso es el mineral de mayor dureza.
Un momento... entonces en el grafito ¿cómo se distribuyen los átomos? Bueno, de eso no he hecho imagenes, pero se puede ver bien la wikipedia que el en el grafito los átomos de carbono se distribuyen en láminas como panales, formando hexágonos, de manera que en esa red (hcp o hexagonal compacta) lo que sucede es que se aprovecha mejor el espacio y los átomos ocupan el mínimo espacio posible, aunque en contrapartida, debido a la estructura laminar, es más frágil.
Y para finalizar, un brillante no es más que un diamante tallado de una manera especial. La talla del diamante tiene que ser muy exacta para aprovechar la estructura de la que hemos hablado y que los reflejos de luz sean todo lo impresionantes que tienen que ser. También hay otros tipos de tallas para diamantes, pero para leer más sobre eso, es mejor que paseis a esta otra página.
Etiquetas: Física clásica, Hecho en casa



2 Comentarios:
El caso es que de una forma estricta un diamante NO es para siempre, tal y como se explica en esta
página web sobre el diamante
Muy interesante y muy visual, gracias
www.juzamdjinn.blogspot.com
Publicar un comentario
<< Inicio